|
Nature:這182個基因,幫助癌細胞逃脫免疫系統追殺时间:2020-12-03 【转载】 阅读 Nature:這182個基因,幫助癌細胞逃脫免疫系統追殺在過去的十年中不同形式的免疫治療已經成為真正有效的癌癥治療方法,以PD-1/PD-L1抑制劑為代表的癌癥免疫療法徹底改變了癌癥領域。然而,免疫治療只在一部分患者中產生持久反應,而不是對所有癌癥類型都能產生持久反應。癌細胞會發生所謂的癌癥抗性突變,導致對治療的惡化反應,因此,在分子水平上了解癌癥如何發展對免疫療法的抵抗力,使癌癥免疫療法更廣泛地應用,這一點非常重要。2020年9月23日,Nature 雜志在線發表了加拿大多倫多大學 Jason Moffat 團隊題為:Functional genomic landscape of cancer-intrinsic evasion of killing by T cells 的研究論文。研究團隊通過CRISPR篩選,在乳腺癌、結直腸癌、腎癌和黑色素瘤的6種小鼠腫瘤細胞中進行篩選,成功鑒定了182個“核心癌癥固有免疫逃逸基因”,這些基因的缺失使癌細胞對T細胞攻擊更加敏感或更具有抵抗力。這項研究成功繪制了癌癥免疫逃逸基因圖譜,為開發免疫療法鋪平了道路。
在免疫療法中,通過改造癌癥患者自身的免疫細胞(殺傷性T細胞)用以發現和消滅癌細胞的CAR-T療法,在白血病、淋巴瘤等血液類癌癥中取得了輝煌成就,但是,對大多數癌癥患者,尤其是實體瘤患者,CAR-T療法效果不佳。
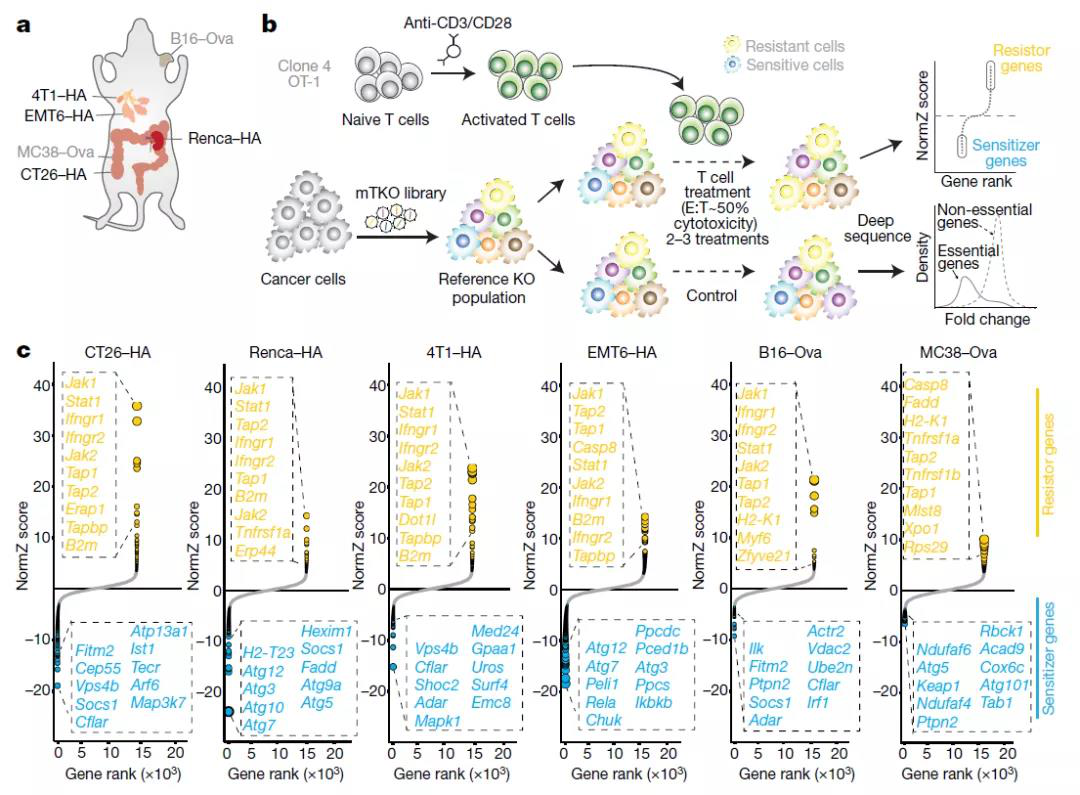
這是免疫系統與癌細胞之間的一場戰爭,免疫系統試圖尋找并殺死癌細胞,而癌細胞則努力逃避免疫系統的殺傷作用。 個體內和個體間腫瘤細胞的不同變異會導致腫瘤異質性,從而影響對治療的反應,使癌癥治療變得更加復雜。所以,找到在一種腫瘤中導致免疫逃逸的基因,意義并不大,我們需要找到的是在多種癌癥中調控免疫逃逸的基因,這才是極佳治療靶標。 研究團隊使用了CRISPR篩選技術,尋找可調控來自乳腺癌(4T1 、EMT6)、結直腸癌(CT26、MC38)、腎癌(Renca)和黑色素瘤(B16)的六種遺傳多樣性腫瘤模型中免疫逃逸的基因。研究團隊成功鑒定了182個“核心癌癥固有免疫逃逸基因”,這些基因的缺失使癌細胞對T細胞攻擊更加敏感或更具有抵抗力。
研究團隊發現,這些增強癌癥免疫逃逸的基因包含了目前所有已確認的對免疫療法無效的癌癥患者出現的突變基因,進一步表明該方法的有效性。 這182個“核心癌癥固有免疫逃逸基因”,有許多基因之前沒有發現與免疫逃逸有任何聯系。這意味著這一癌癥免疫逃逸基因圖譜包含了豐富的新的生物學信息。 細胞自噬(Autophagy)是細胞加速循環利用其成分以減輕壓力后損傷的過程,自噬相關基因是免疫逃逸的關鍵,因此,靶向自噬基因來增強癌癥對免疫療法的敏感性的方法似乎具有可行性。 然而,研究團隊進一步深入研究發現,成對刪除某些自噬基因會使細胞對免疫系統殺傷具有抵抗力。這意味著,如果腫瘤已經出現了一個自噬基因突變,那么將免疫療法與靶向另一種自噬基因的藥物相結合的治療方法,反而會使該患者的疾病惡化。這是之前從未預料到的。 更重要的是,該研究表明自噬通路的多效性可能會導致靶向單個基因的免疫療法失效,遺傳背景、已存在哪些突變,在很大程度上決定了引入第二種突變是否對免疫治療無效、增強抵抗或增加敏感性。 總的來說,該研究通過對功能和遺傳上不同的腫瘤細胞系進行CRISPR篩選,確定了一 組核心保守的介導癌癥免疫逃逸的基因和通路,為開發免疫療法鋪平了道路。
論文鏈接: https://www.nature.com/articles/s41586-020-2746-2 |